Apa Itu Rumus Empiris? Yuk, Kita Bedah Sampai Tuntas! | Kimia Kelas 10
Apa yang dimaksud dengan rumus empiris dari suatu senyawa kimia? Apa bedanya dengan rumus molekul? Yuk, pelajari dengan membaca artikel berikut ini!
—
Kamu pasti sudah tahu dong bahwa rumus kimia merupakan salah satu ciri khas dari senyawa kimia? Nah, ternyata rumus kimia itu terbagi menjadi dua lho, yaitu rumus empiris dan rumus molekul. Apa sih bedanya?
Rumus empiris adalah rumus yang menyatakan perbandingan jumlah unsur-unsur penyusun molekul yang paling sederhana. Sedangkan rumus molekul adalah rumus sebenarnya yang menyatakan jumlah unsur-unsur yang menyusun suatu molekul.
Rumus empiris diperoleh berdasarkan percobaan. Contohnya, rumus molekul benzena adalah C6H6 dan rumus empirisnya adalah CH. Supaya kamu lebih paham, coba perhatikan gambar berikut!
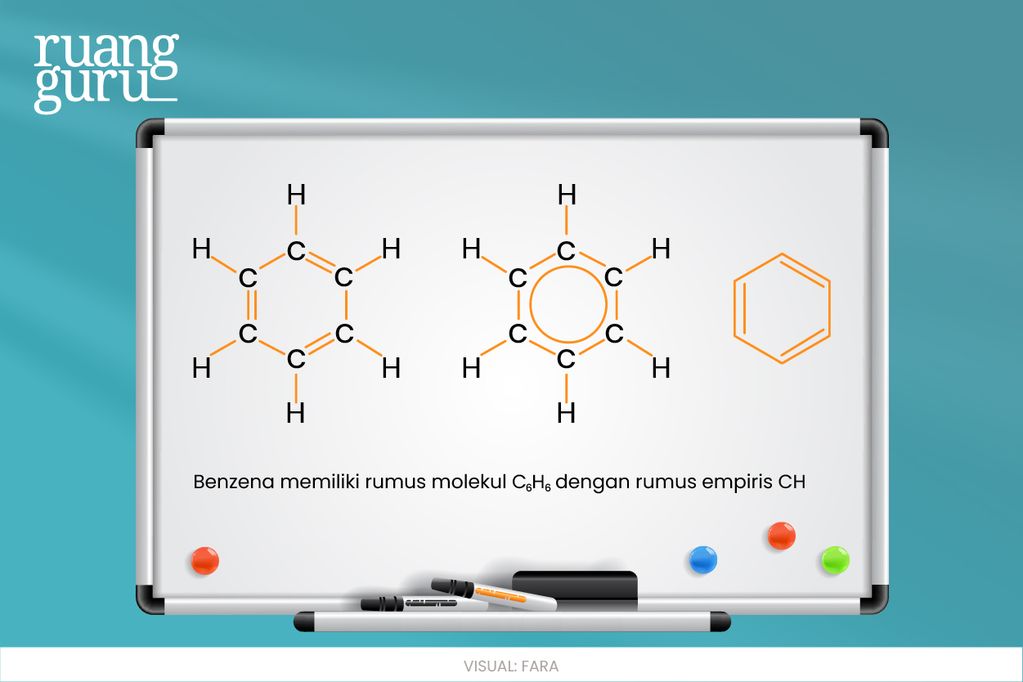
Rumus empiris dapat digunakan untuk menunjukkan rumus molekul apabila tidak ada informasi tentang massa molekul relatif dari suatu senyawa. Misalnya, NO2 dapat dikatakan sebagai rumus molekul jika tidak ada informasi massa molekul relatifnya. Tapi, jika massa molekul relatifnya diketahui, misalnya 92, maka NO2 merupakan rumus empiris karena rumus molekul senyawa tersebut adalah N2O4.
Perbedaan Rumus Empiris dan Rumus Molekul
Perbedaan rumus empiris dan rumus molekul terletak pada jumlah atomnya, tapi jenis atom unsur penyusun senyawanya tetap sama.
Aduh aduh, bentar. Bingung dikit. Diulang lagi boleh, nggak?
Hehe, jadi gini. Misalnya, peroksida memiliki rumus molekul H2O2, sedangkan rumus empirisnya adalah HO. Nah, atom unsur penyusun senyawanya sama-sama H dan O, kan? Tapi, jumlah atomnya saja yang berbeda. Jadi, perbedaan antara rumus molekul dan rumus empiris terletak pada jumlah atomnya.
Supaya lebih paham, kamu bisa perhatikan contoh rumus empiris dan rumus molekul pada tabel berikut ini. Check it out!

Cara Menghitung Rumus Empiris
Cara untuk menentukan rumus empiris yaitu perlu terlebih dahulu mencari massa atau persentase massa dalam senyawa. Setelah itu, dibagi dengan massa atom relatif (Ar) masing-masing unsur. Artinya, dalam menentukan rumus empiris, perlu dicari perbandingan mol dari unsur-unsur dalam senyawa tersebut.
Rumus empiris dan rumus molekul bisa dijabarkan sebagai berikut:
(Rumus Empiris)n = Rumus Molekul
Nilai n berkaitan dengan massa molekul relatif (Mr) dari suatu rumus kimia. Jika Mr dari rumus empiris dikalikan dengan n, maka menghasilkan Mr rumus molekul. Prinsip ini digunakan sebagai dasar dalam mencari rumus molekul senyawa.
Supaya kamu lebih paham, coba kerjakan contoh soal di bawah ini, yuk!
Contoh Soal Rumus Empiris
1. Suatu senyawa yang memiliki massa 100 gram mengandung unsur karbon, hidrogen, dan oksigen dengan persentase sebagai berikut:
- 41,82% untuk atom C
- 6,51% untuk atom H
- 51,67% untuk atom O
Tentukan rumus empiris senyawa tersebut!
Penyelesaian:
Diketahui:
Persentase unsur C = 41,82%
Persentase unsur H = 6,51%
Persentase unsur O = 51,67%
Ditanya:
Rumus empiris?
Jawab:
Massa senyawa sebesar 100 gram, maka:
Massa C = 41,82 gram
Massa H = 6,51 gram
Massa O = 51,67 gram
Kemudian, cari jumlah mol masing-masing unsur dengan rumus sebagai berikut:

Karena perbandingan jumlah mol juga menyatakan perbandingan jumlah atom, maka perbandingan jumlah mol dapat digunakan untuk menentukan rumus empiris.
mol C : mol H : mol O = atom C : atom H : atom O = 3,485 : 6,510 : 3,229
Karena atom-atom dalam molekul merupakan kelipatan bilangan bulat, maka perbandingan atom di atas harus bilangan bulat dan harus lebih sederhana, sehingga harus membagi ketiga bilangan di atas dengan kelipatan bilangan paling kecil yaitu 3,229. Perbandingannya menjadi:
1,07 : 2,01 : 1,00
Perbedaan angka di belakang koma pada desimal kedua dapat diabaikan, dengan demikian perbandingan atom C, H dan O adalah:
1 : 2 : 1
Perbandingan ini menyatakan perbandingan atom-atom paling sederhana dalam molekul. Dengan demikian, rumus empiris senyawa adalah CH2O.
Nah, itu tadi pembahasan lengkap tentang rumus empiris, mulai dari pengertian, perbedaannya dengan rumus molekul, hingga cara menghitung rumus empiris beserta contoh soalnya. Sekarang, kamu sudah paham, kan? Kalau kamu masih punya pertanyaan lain tentang materi ini, kamu bisa langsung tanyakan di Roboguru! Yuk, cobain sekarang!
Artikel ini pertama kali ditulis oleh Karina Dwi Adistiana dan telah diperbarui oleh Kenya Swawikanti pada 27 Mei 2022.











